Kachexie ist eine systemische Erkrankung, die durch Gewichtsverlust, Muskel- und Fettgewebeschwund sowie systemische Entzündungen gekennzeichnet ist. Kachexie ist eine der häufigsten Komplikationen und Todesursachen bei Krebspatienten. Neben Krebs kann Kachexie auch durch eine Vielzahl chronischer, nicht bösartiger Erkrankungen verursacht werden, darunter Herzinsuffizienz, Nierenversagen, chronisch obstruktive Lungenerkrankung, neurologische Erkrankungen, AIDS und rheumatoide Arthritis. Schätzungsweise 25 bis 70 % der Krebspatienten leiden an Kachexie, was die Lebensqualität der Patienten erheblich beeinträchtigt und die behandlungsbedingte Toxizität verschlimmert.
Eine wirksame Behandlung der Kachexie ist für die Verbesserung der Lebensqualität und Prognose von Krebspatienten von großer Bedeutung. Trotz einiger Fortschritte bei der Erforschung der pathophysiologischen Mechanismen der Kachexie sind viele auf der Grundlage möglicher Mechanismen entwickelte Medikamente jedoch nur bedingt oder gar nicht wirksam. Derzeit gibt es keine von der US-amerikanischen Food and Drug Administration (FDA) zugelassene wirksame Behandlung.
Das Scheitern klinischer Studien zur Kachexie hat viele Gründe. Der Hauptgrund dürfte im mangelnden Verständnis des Mechanismus und des natürlichen Verlaufs der Kachexie liegen. Kürzlich veröffentlichten Professor Xiao Ruiping und der Forscher Hu Xinli vom College of Future Technology der Peking-Universität gemeinsam einen Artikel in Nature Metabolism, in dem sie die wichtige Rolle des Milchsäure-GPR81-Signalwegs bei der Entstehung von Krebskachexie aufzeigten und neue Ansätze für die Behandlung von Kachexie lieferten. Wir fassen dies anhand von Artikeln aus Nat Metab, Science, Nat Rev Clin Oncol und anderen Zeitschriften zusammen.
Gewichtsverlust ist in der Regel auf eine reduzierte Nahrungsaufnahme und/oder einen erhöhten Energieverbrauch zurückzuführen. Frühere Studien legten nahe, dass diese physiologischen Veränderungen bei tumorassoziierter Kachexie durch bestimmte Zytokine verursacht werden, die vom Tumormikromilieu sezerniert werden. Beispielsweise können Faktoren wie Wachstumsdifferenzierungsfaktor 15 (GDF15), Lipocalin-2 und insulinähnliches Protein 3 (INSL3) die Nahrungsaufnahme hemmen, indem sie an appetitregulierende Stellen im zentralen Nervensystem binden, was bei Patienten zu Anorexie führt. IL-6, PTHrP, Activin A und andere Faktoren fördern Gewichtsverlust und Gewebeatrophie, indem sie den katabolen Stoffwechselweg aktivieren und den Energieverbrauch erhöhen. Die Forschung zum Mechanismus der Kachexie konzentrierte sich bisher hauptsächlich auf diese sezernierten Proteine, und nur wenige Studien untersuchten den Zusammenhang zwischen Tumormetaboliten und Kachexie. Professor Xiao Ruiping und Forscher Hu Xinli verfolgten einen neuen Ansatz, um den wichtigen Mechanismus der tumorassoziierten Kachexie aus der Perspektive der Tumormetaboliten aufzudecken.
Zunächst untersuchte das Team von Professor Xiao Ruiping Tausende von Metaboliten im Blut gesunder Kontrollpersonen und von Mäusen mit Lungenkrebskachexie. Dabei stellte sich heraus, dass Milchsäure der am stärksten erhöhte Metabolit bei Mäusen mit Kachexie war. Der Milchsäurespiegel im Serum stieg mit dem Tumorwachstum an und zeigte eine starke Korrelation mit der Gewichtsveränderung tumortragender Mäuse. Serumproben von Lungenkrebspatienten bestätigen, dass Milchsäure auch bei der Progression der menschlichen Krebskachexie eine Schlüsselrolle spielt.
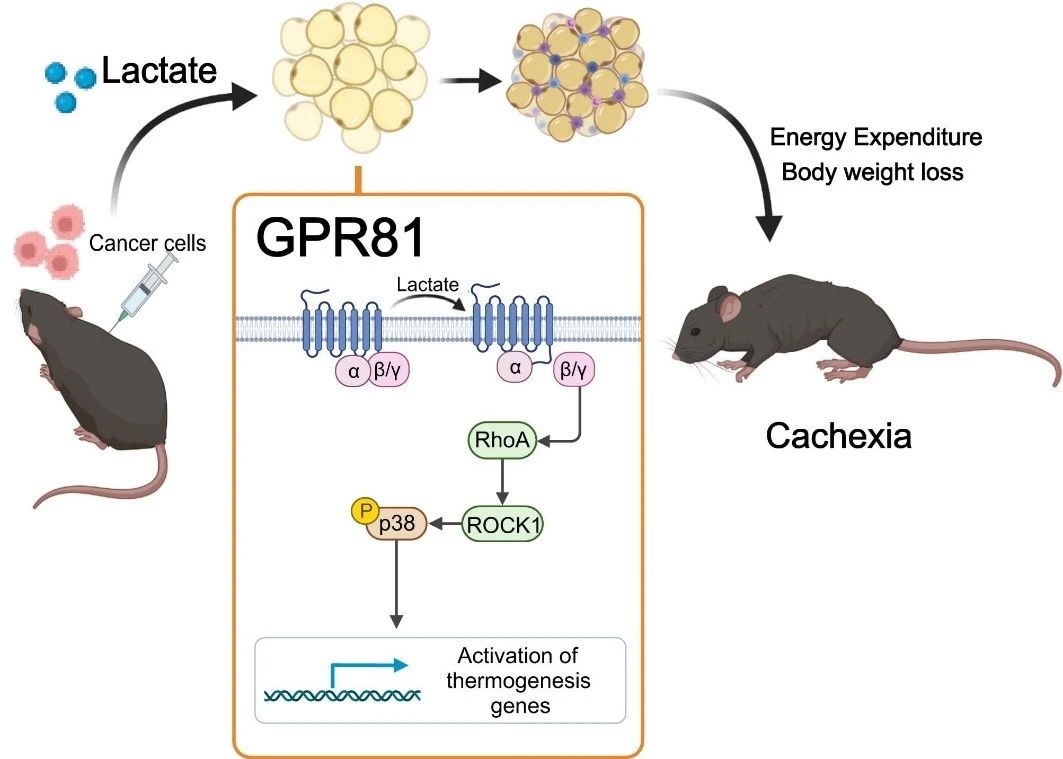
Um herauszufinden, ob hohe Milchsäurewerte Kachexie verursachen, führte das Forschungsteam dem Blut gesunder Mäuse Milchsäure über eine unter die Haut implantierte osmotische Pumpe zu. Dadurch wurde der Milchsäurespiegel im Serum künstlich auf das Niveau von Mäusen mit Kachexie angehoben. Nach zwei Wochen entwickelten die Mäuse ein typisches Kachexie-Phänotyp, wie Gewichtsverlust sowie Fett- und Muskelschwund. Diese Ergebnisse deuten darauf hin, dass die durch Laktat induzierte Fettumbildung der durch Krebszellen induzierten ähnelt. Laktat ist nicht nur ein charakteristischer Metabolit der Krebskachexie, sondern auch ein wichtiger Mediator des krebsinduzierten hyperkatabolen Phänotyps.
Als nächstes fanden sie heraus, dass die Deletion des Laktatrezeptors GPR81 Tumor- und Serumlaktat-induzierte Kachexie-Manifestationen wirksam linderte, ohne den Serumlaktatspiegel zu beeinflussen. Da GPR81 im Fettgewebe stark exprimiert wird und sich das Fettgewebe während der Entwicklung einer Kachexie früher verändert als die Skelettmuskulatur, ähnelt der spezifische Knockout-Effekt von GPR81 im Fettgewebe von Mäusen dem eines systemischen Knockouts und verbessert den tumorbedingten Gewichtsverlust sowie den Fett- und Skelettmuskelverbrauch. Dies deutet darauf hin, dass GPR81 im Fettgewebe für die Entwicklung einer durch Milchsäure verursachten Krebskachexie erforderlich ist.
Weitere Studien bestätigten, dass Milchsäuremoleküle nach der Bindung an GPR81 die Fettbräunung, Lipolyse und erhöhte systemische Wärmeproduktion über den Gβγ-RhoA/ROCK1-p38-Signalweg und nicht über den klassischen PKA-Signalweg vorantreiben.
Trotz vielversprechender Ergebnisse in der Pathogenese der krebsbedingten Kachexie haben sich diese Erkenntnisse noch nicht in wirksame Behandlungen niedergeschlagen. Daher gibt es derzeit keine Behandlungsstandards für diese Patienten. Einige Gesellschaften, wie die ESMO und die European Society of Clinical Nutrition and Metabolism, haben jedoch klinische Leitlinien entwickelt. Derzeit empfehlen internationale Leitlinien dringend, den Stoffwechsel zu fördern und den Katabolismus durch Maßnahmen wie Ernährung, Bewegung und Medikamente zu reduzieren.
Veröffentlichungszeit: 28. April 2024