Nosokomiale Pneumonie ist die häufigste und schwerwiegendste nosokomiale Infektion. Davon entfallen 40 % auf die beatmungsassoziierte Pneumonie (VAP). VAP, die durch refraktäre Erreger verursacht wird, ist nach wie vor ein schwieriges klinisches Problem. Seit Jahren empfehlen Leitlinien eine Reihe von Interventionen (wie gezielte Sedierung, Hochlagerung des Kopfes) zur Vorbeugung von VAP. Allerdings tritt VAP bei bis zu 40 % der Patienten mit endotrachealer Intubation auf, was zu längeren Krankenhausaufenthalten, einem erhöhten Antibiotikaeinsatz und zum Tod führt. Die Suche nach wirksameren Präventionsmaßnahmen ist daher unablässig.
Die beatmungsassoziierte Pneumonie (VAP) ist eine neu auftretende Lungenentzündung, die 48 Stunden nach der endotrachealen Intubation auftritt und die häufigste und tödlichste nosokomiale Infektion auf der Intensivstation (ICU) darstellt. In den Leitlinien der American Society of Infectious Diseases aus dem Jahr 2016 wird zwischen VAP und der im Krankenhaus erworbenen Pneumonie (HAP) unterschieden (HAP bezeichnet nur Lungenentzündungen, die nach einem Krankenhausaufenthalt ohne endotrachealen Tubus auftreten und nicht mit mechanischer Beatmung in Zusammenhang stehen; VAP ist eine Lungenentzündung nach endotrachealer Intubation und mechanischer Beatmung), und die europäische Gesellschaft und China sind der Ansicht, dass VAP dennoch eine Sonderform der HAP ist [1-3].
Bei Patienten mit künstlicher Beatmung liegt die Inzidenz von VAP zwischen 9 % und 27 %, die Sterblichkeitsrate wird auf 13 % geschätzt und kann zu einem erhöhten systemischen Antibiotikaeinsatz, längerer künstlicher Beatmung, längeren Aufenthalten auf der Intensivstation und erhöhten Kosten führen [4-6]. HAP/VAP bei nicht immungeschwächten Patienten wird normalerweise durch eine bakterielle Infektion verursacht, und die Verbreitung gängiger Erreger und ihre Resistenzeigenschaften variieren je nach Region, Krankenhausklasse, Patientenpopulation und Antibiotikaexposition und verändern sich im Laufe der Zeit. Pseudomonas aeruginosa dominierte die VAP-assoziierten Erreger in Europa und Amerika, während in chinesischen Krankenhäusern der tertiären Versorgung mehr Acinetobacter baumannii isoliert wurden. Ein Drittel bis die Hälfte aller VAP-assoziierten Todesfälle sind direkt auf die Infektion zurückzuführen, wobei die Sterblichkeitsrate der durch Pseudomonas aeruginosa und Acinetobacter verursachten Fälle höher ist [7,8].
Aufgrund der starken Heterogenität der VAP ist die diagnostische Spezifität ihrer klinischen Manifestationen, Bildgebungs- und Labortests gering und das Spektrum der Differentialdiagnosen ist breit, was eine rechtzeitige Diagnose der VAP erschwert. Gleichzeitig stellt die bakterielle Resistenz eine ernsthafte Herausforderung für die Behandlung der VAP dar. Es wird geschätzt, dass das Risiko, an VAP zu erkranken, während der ersten 5 Tage der mechanischen Beatmung 3 %/Tag beträgt, zwischen 5 und 10 Tagen bei 2 %/Tag und für den Rest der Zeit bei 1 %/Tag. Die höchste Inzidenz wird im Allgemeinen nach 7 Tagen Beatmung erreicht, es besteht also ein Zeitfenster, in dem eine Infektion frühzeitig verhindert werden kann [9,10]. Viele Studien haben sich mit der Prävention der VAP befasst, aber trotz jahrzehntelanger Forschung und Bemühungen zur VAP-Prävention (wie Vermeidung von Intubation, Vermeidung von Reintubation, Verringerung der Sedierung, Anheben des Kopfendes des Bettes um 30° bis 45° und Mundpflege) scheint die Inzidenz nicht zurückgegangen zu sein und die damit verbundene medizinische Belastung ist nach wie vor sehr hoch.
Inhalative Antibiotika werden seit den 1940er Jahren zur Behandlung chronischer Atemwegsinfektionen eingesetzt. Da sie die Wirkstoffabgabe an den Infektionsort (die Atemwege) maximieren und systemische Nebenwirkungen reduzieren können, haben sie sich bei einer Vielzahl von Erkrankungen bewährt. Inhalative Antibiotika sind mittlerweile von der US-amerikanischen Food and Drug Administration (FDA) und der Europäischen Arzneimittel-Agentur (EMA) zur Behandlung von Mukoviszidose zugelassen. Sie können die bakterielle Belastung und die Häufigkeit von Exazerbationen bei Bronchiektasien deutlich senken, ohne die Zahl der Nebenwirkungen zu erhöhen. In den aktuellen Leitlinien werden sie als Erstlinientherapie für Patienten mit einer Pseudomonas-aeruginosa-Infektion und häufigen Exazerbationen anerkannt. Inhalative Antibiotika können während der perioperativen Phase einer Lungentransplantation auch adjuvant oder prophylaktisch eingesetzt werden [11,12]. In den US-amerikanischen VAP-Leitlinien von 2016 zweifelten Experten jedoch an der Wirksamkeit adjuvanter inhalativer Antibiotika, da große randomisierte kontrollierte Studien fehlten. Auch die im Jahr 2020 veröffentlichte Phase-3-Studie (INHALE) lieferte keine positiven Ergebnisse (Inhalation von Amikacin unterstützte intravenöse Antibiotika gegen eine durch VAP-Patienten verursachte Infektion mit gramnegativen Bakterien, eine doppelblinde, randomisierte, Placebo-kontrollierte Wirksamkeitsstudie der Phase 3 mit insgesamt 807 Patienten, systemische Medikation + unterstützte Inhalation von Amikacin über 10 Tage).
In diesem Zusammenhang verfolgte ein Team unter der Leitung von Forschern des regionalen Universitätsklinikums von Tours (CHRU) in Frankreich eine andere Forschungsstrategie und führte eine Prüfarzt-initiierte, multizentrische, doppelblinde, randomisierte, kontrollierte Wirksamkeitsstudie (AMIKINHAL) durch. Inhaliertes Amikacin oder Placebo wurden zur VAP-Prävention auf 19 Intensivstationen in Frankreich verglichen [13].
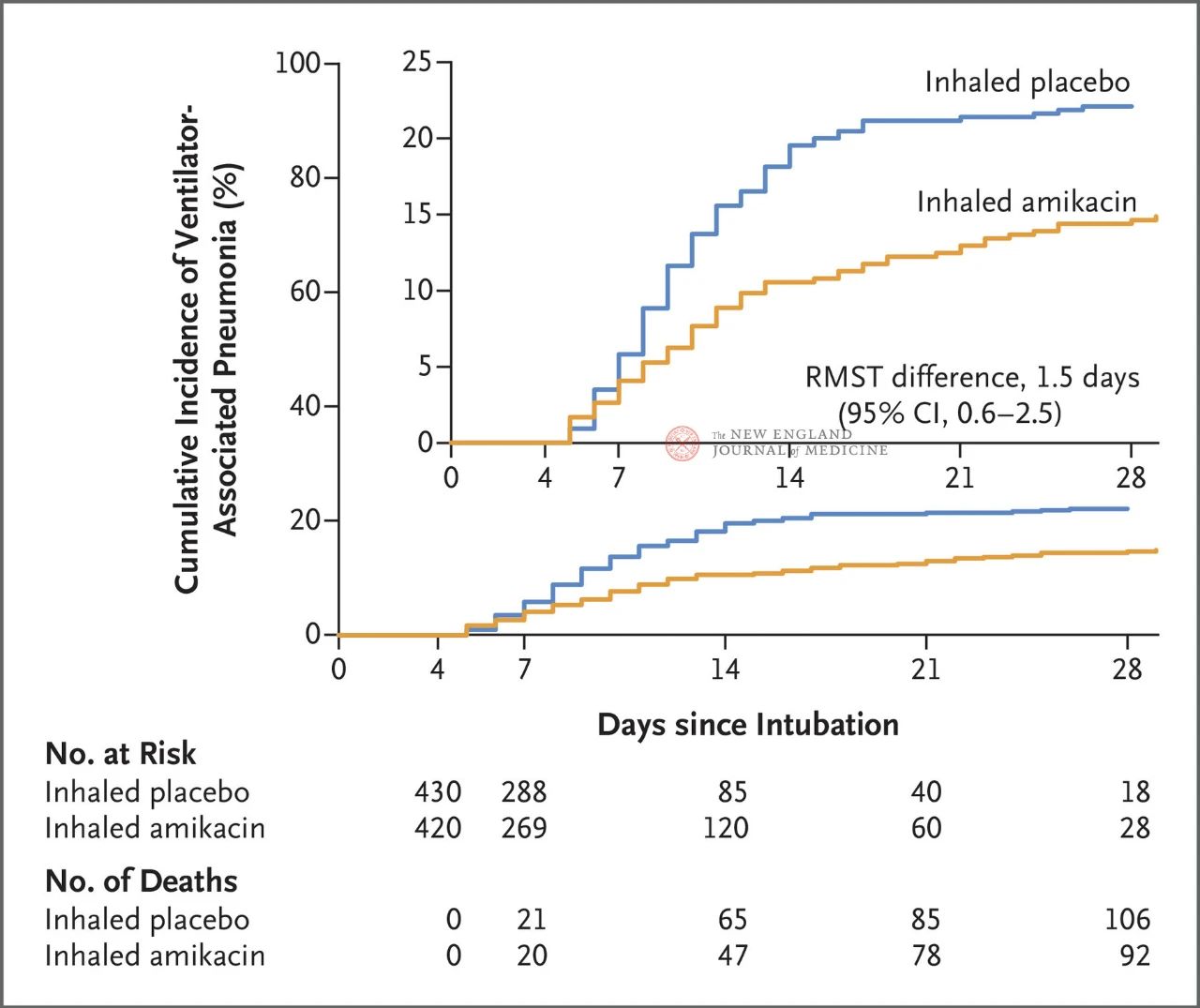
Insgesamt 847 erwachsene Patienten mit invasiver mechanischer Beatmung zwischen 72 und 96 Stunden wurden randomisiert im Verhältnis 1:1 einer Behandlung mit Amikacin (N=417, 20 mg/kg Idealgewicht, einmal täglich) oder Placebo (N=430, 0,9% Natriumchloridäquivalent) über drei Tage zugewiesen. Primärer Endpunkt war die erste VAP-Episode vom Beginn der randomisierten Zuteilung bis zum 28. Tag.
Die Ergebnisse der Studie zeigten, dass nach 28 Tagen 62 Patienten (15 %) in der Amikacin-Gruppe und 95 Patienten (22 %) in der Placebo-Gruppe eine VAP entwickelt hatten (der begrenzte mittlere Überlebensunterschied für VAP betrug 1,5 Tage; 95 % KI, 0,6–2,5; P = 0,004).
In Bezug auf die Sicherheit traten bei sieben Patienten (1,7 %) in der Amikacin-Gruppe und vier Patienten (0,9 %) in der Placebo-Gruppe studienbedingte schwerwiegende Nebenwirkungen auf. Unter denjenigen, die bei der Randomisierung kein akutes Nierenversagen hatten, hatten 11 Patienten (4 %) in der Amikacin-Gruppe und 24 Patienten (8 %) in der Placebo-Gruppe am Tag 28 ein akutes Nierenversagen (HR: 0,47; 95 % KI: 0,23–0,96).
Die klinische Studie hatte drei Höhepunkte. Erstens orientiert sich die AMIKINHAL-Studie hinsichtlich ihres Studiendesigns an der IASIS-Studie (einer randomisierten, doppelblinden, placebokontrollierten Parallelstudie der Phase 2 mit 143 Patienten zur Bewertung der Sicherheit und Wirksamkeit der systemischen Inhalation von Amikacin und Fosfomycin bei Infektionen mit gramnegativen Bakterien durch VAP) und der INHALE-Studie, die negative Ergebnisse lieferte und sich auf die Prävention von VAP konzentrierte, aber relativ gute Ergebnisse erzielte. Angesichts der hohen Sterblichkeit und der langen Krankenhausaufenthaltsdauer bei Patienten mit mechanischer Beatmung und VAP wäre die Inhalation von Amikacin für die klinische Praxis wertvoller, wenn sie bei diesen Patienten signifikant unterschiedliche Ergebnisse hinsichtlich der Verkürzung der Sterblichkeit und der Krankenhausaufenthaltsdauer erzielen könnte. Angesichts der Heterogenität der Spätbehandlung und -versorgung bei jedem Patienten und in jedem Zentrum gibt es jedoch eine Reihe von Störfaktoren, die die Studie beeinträchtigen können, sodass es auch schwierig sein kann, ein positives Ergebnis zu erzielen, das auf die inhalierten Antibiotika zurückzuführen ist. Daher erfordert eine erfolgreiche klinische Studie nicht nur ein hervorragendes Studiendesign, sondern auch die Auswahl geeigneter primärer Endpunkte.
Zweitens: Obwohl Aminoglykosid-Antibiotika in verschiedenen VAP-Leitlinien nicht als Einzelmedikament empfohlen werden, können Aminoglykosid-Antibiotika häufige Krankheitserreger bei VAP-Patienten (einschließlich Pseudomonas aeruginosa, Acinetobacter usw.) abdecken. Aufgrund ihrer begrenzten Absorption in Lungenepithelzellen, ihrer hohen Konzentration am Infektionsort und ihrer geringen systemischen Toxizität werden Aminoglykosid-Antibiotika unter den inhalativen Antibiotika weithin bevorzugt. Diese Arbeit steht im Einklang mit der zuvor veröffentlichten umfassenden Schätzung der Effektstärke der intratrachealen Verabreichung von Gentamicin in kleinen Stichproben, die gemeinsam die Wirkung inhalativer Aminoglykosid-Antibiotika bei der Vorbeugung von VAP zeigt. Es ist zudem zu beachten, dass die meisten der in den Studien zu inhalativen Antibiotika ausgewählten Placebo-Kontrollen physiologische Kochsalzlösung sind. Da jedoch die zerstäubte Inhalation von physiologischer Kochsalzlösung selbst eine gewisse Rolle bei der Verdünnung des Auswurfs und der Expektoranswirkung spielen kann, kann physiologische Kochsalzlösung die Analyse der Studienergebnisse beeinträchtigen, was bei der Studie umfassend berücksichtigt werden sollte.
Darüber hinaus ist eine lokale Anpassung der HAP/VAP-Medikation wichtig, ebenso wie eine Antibiotikaprophylaxe. Gleichzeitig ist die Ökologie der lokalen Intensivstation, unabhängig von der Intubationsdauer, der wichtigste Risikofaktor für eine Infektion mit multiresistenten Bakterien. Deshalb sollte sich die empirische Behandlung so weit wie möglich an den mikrobiologischen Daten der lokalen Krankenhäuser orientieren und darf nicht blind auf den Leitlinien oder Erfahrungen von Krankenhäusern der tertiären Versorgung beruhen. Gleichzeitig weisen schwer erkrankte Patienten, die eine mechanische Beatmung benötigen, häufig Multisystemerkrankungen auf, und unter dem kombinierten Einwirken mehrerer Faktoren, wie z. B. Stress, kann es auch zu einer Überlagerung von Darmmikroben in die Lunge kommen. Die große Heterogenität der Erkrankungen, die durch interne und externe Überlagerungen verursacht wird, macht es auch noch lange nicht möglich, jede neue Intervention in großem Maßstab klinisch zu etablieren.
Veröffentlichungszeit: 02.12.2023